Сколько раствора получится из 50 кг цемента?
Очень часто нужно быстро приготовить строительный раствор для кладки, но приобретать лишний цемент не хочется, ведь придется переплачивать за него. Как же рассчитать точное количество требуемого цемента в мешках? Давайте попробуем рассчитать.
Цементный раствор – это строительный материал состоящий в общем случае из трех компонентов:
- Цемент разных марок как основа-связующее.
- Песок как наполнитель. В зависимости от назначения раствора: речной, карьерный или намывной.
- Вода как затворитель.
При этом в зависимости целей (строительство стяжки пола, заделка трещин, оштукатуривание, кладка кирпича и пр.), замешивают различные пропорции компонентов. К примеру, для приготовления раствора для стяжки пола используют следующие пропорции:
- Один мешок цемента марки М400-М500, массой 50 кг(1 часть)
- Три мешка песка (3 части – 150 кг).
- Вода – 25 литров или ½ от количества цемента.

Без сомнения, указанные цифры довольно приблизительные, и на практике нуждаются в корректировке в зависимости от требуемой марки раствора согласно ГОСТ, марки цемента, характеристик песка и других факторов.
К числу «других факторов» можно отнести использование добавок – пластификаторов. Пластификаторы существенно влияют на пропорциональное соотношение компонентов раствора.
Однако если говорить о частном строительстве «своими руками», указанные выше данные вполне могут быть использованы на практике. В конечном итоге, из мешка цемента массой 50 кг получается чуть больше 0,2 м3 раствора.
Следующий распространенный вид раствора – материал для заделки трещин и неровностей на стенах. В этом случае раствор замешивают в пропорциях 50/50, только вода и цемент без наполнителя (песка). В этом случае, из мешка цемента получается 0,1 м3 раствора.
Для удобства приготовления раствора или бетона для заливки фундамента, состав компонентов принято давать в пропорциях, привязываясь к количеству цемента.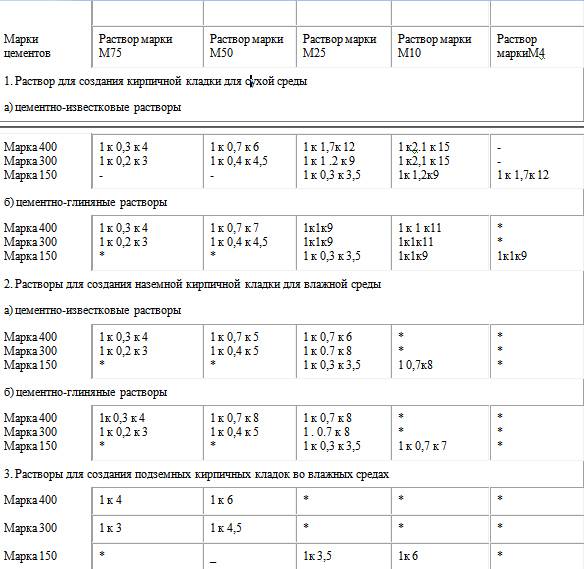
Полезный совет – оптимальный вариант «наполнителя-балласта» – три части каменной или гравийной крошки смешанной с одной частью речного песка. В этом случае из 1 мешка цемента, выход готового материала составляет – 0,3 м3 бетона (раствора).
Кладочный раствор, используемый для строительства стен из кирпича, пеноблока, шлакоблока или ракушечника готовится следующим образом: цемент и песок в соотношении 1:5, если кладка идет над поверхностью грунта и 1:3 если кладка идет ниже уровня грунта. Соответственно последней пропорции, выход материала из 1 мешка цемента составляет – 0,2 м3.
В любом случае, перед тем как начать готовить и замешивать компоненты, внимательно изучите инструкцию с возможными вариантами пропорций, которая имеется на каждом мешке цемента.
Калькулятор расхода кирпича и раствора для кладки
И в профессиональном, и в индивидуальном строительстве необходимо достаточно точно рассчитывать расход раствора на кладку кирпича с тем, чтобы не заказывать или не замешивать самостоятельно лишнюю рабочую смесь. При больших объемах строительства можно превысить смету, а лишний ПЦР быстро утеряет свои рабочие свойства и никуда больше не пригодится. При вычислениях количества рабочей смеси на 1 м3 поверхности из кирпича даже по приблизительным формулам вероятность потерь становится намного меньше. Более точный результат, вы получите используя Калькулятор расхода кирпича и раствора для кладки.
Содержание
- Какие составы используются
- Затраты раствора на кубический метр перегородки
- Раствор для стены — сколько нужно на 1 м2
- Нормы расхода строительной смеси для разных видов строительных блоков
- Затраты кирпича на 1м3 стены
- Как рассчитать количество единиц для цоколя?
- Расход цемента в мешках для 1 м2 стены
- Заключение
Какие составы используются
Самые известные и востребованные смеси:
- Традиционный универсальный строительный состав из песка и портландцемента.
 Стандартное соотношение компонентов – три к одному или четыре к одному;
Стандартное соотношение компонентов – три к одному или четыре к одному; - Рабочая смесь из песка и негашеной извести. Применяется только для внутренних кладочных работ;
- Смешанный состав для кирпичной кладки. Это кварцевый песок, цемент и гашеная известь;
- Цементные смеси с добавками-пластификаторами.
Общие нормы согласно СНиП II-22–81: песок нужно промывать и просеивать, известковое молочко должно быть процеженным, цемент – свежим и без комков. Все составы затворяются чистой технической водой. В сухие перемешанные компоненты воду доливают порциями, до набора требуемой консистенции.
Затраты раствора на кубический метр перегородки
На нормы расхода раствора на 1 м3 влияют такие параметры процесса:
- Толщина основы и качество кирпичных блоков;
- Разновидность кирпича — он может быть полнотелым или пустотелым;
- Климатические условия – температура и влажность воздуха, солнечный или пасмурный день.
Для рядового блока размером 250 х 120 х 65 мм расход раствора на 1 м3 при толщине слоя рабочей смеси 10-12 мм такой: В одном кубометре порядовки находится приблизительно 404–405 рядовых блоков, а на один рядовой блок потребляется примерно 0,00063 м3 цементной смеси, или 0,63 литра.
На один квадратный метр основания потребляется приблизительно 100-105 брикетов.
Практика показывает, что для 1м2 сооружения из рядового кирпича необходимо приготовить 75 литров. Конструкция в полтора кирпича потребует приготовления 115 литров рабочей смеси, основа в полкирпича заберет 40 литров цементного состава на 1 м2. Чтобі получить точное количество, используйте Калькулятор расхода кирпича.
Согласно СНиП 82-02-95, которые показывают, нормы расхода раствора на 1 м3 кирпичной кладки следующие:
- 0,19 кубических метра для кладки в полкирпича;
- 0,22 кубических метра для кладки в один кирпич;
- 0,235 кубических метра для кладки в полтора блока;
- 0,24 кубических метра для кладки в два кирпича;
- 0,25 кубических метра для кладки в два с половиной блока.
Более точные и расширенные данные содержатся в СНиП II-22–81.
Раствор для стены — сколько нужно на 1 м
2Как узнать расход раствора на 1 м 2 кладки кирпича? Чтобы не заниматься вычислениями, существует таблица всех входящих в состав компонентов.
В ней учитывается расход раствора на кладку кирпича из разных материалов:
| Разновидность | Состав | Пропорции составляющих для слоя | ||
| Набрызг | Грунт | Накрывочный | ||
| Известь гашеная или негашеная | Известковое молочко и кварцевый песок | 1,0:(2,5-4,0) | 1,0:(2,0-3,0) | 1:(1,0-2,0) |
| Портландцемент | Портландцемент и кварцевый песок | 1,0:(2,5-4,5) | 1,0:(2,0-3,5) | 1,0:(1,0-1,5) |
| Глина | Кварцевый песок и глина | 1,0:(3,0-5,5) | 1,0:(3,0-5,5) | 1,0:(3,0-5,5) |
| Известково-цементный | Портландцемент, известковое молочко и кварцевый песок | 1,0:(0,3-0,5): (3,0-5,0) | 1,0: (0,7-1,0): (2,5-4,5) | 1,0:(1,0-1,5):(1,5-2,5) |
| Гипсово-известковый | Известковое молочко, гипс и кварцевый песок | 1,0:(0,3-1,0): (2,0-3,5) | 1,0:(0,5-1,5):(1,5-2,5) | 1,0:(1,0-1,5): (1,5-2,5) |
| Глиняно-известковый | Известковое молочко, глина и кварцевый песок | 0,2-1,0:(3,0-5,0) | 0,2-1,0:(3,0-5,0) | 0,2-1,0:(3,0-5,0) |
| Глиняно-цементный | Портландцемент, глина и кварцевый песок | 1,0:4,0:12,0 | 1,0:4,0:12,0 | 1,0:4,0:12,0 |
Нормы расхода строительной смеси для разных видов строительных блоков
На одну единицу потребляется около 0,0108 м3 состава, а на покрытие 50% шва уйдет 0,054 м3 смеси. Среднее арифметическое этих двух значений – 0,08 м 3. Это значение определяет расход раствора на 1 м2 кладки кирпича.
Среднее арифметическое этих двух значений – 0,08 м 3. Это значение определяет расход раствора на 1 м2 кладки кирпича.
Для разных кладок этот параметр будет равен:
- При возведении перегородки в полкирпича – 0,04 м3;
- Рядовой — 0,82 м3;
- Полуторный — 0,125 м3;
- Двойной — 0,164 м3.
В таблице отражены нормы расхода раствора на кирпичную кладку из блоков разного размера для перегородок разной толщины:
| Разновидность работ | Объем строительных работ | Объем |
| Кладочные работы | 1 м2 при толщине основы в четверть брикета | 14 литров |
| 1 м2 при толщине основания в полкирпича | 35 литров | |
| 1 м2 при толщине в один кирпич | 75 литров | |
| 1 м2 при толщине стены в полтора кирпича | 115 литров | |
| Оштукатуривание | 1 м2 намета без затирки с применением мелкого гравия | 13 литров |
| 1 м2 штукатурки внутренних поверхностей | 17 литров |
При этом расход раствора на 1 м3 будет равен:
- При работе в полкирпича для 53 строительных единиц — 0,19 м3;
- При одинарной кладке для 102 блоков — 0,22 м3;
- Полуторная для 153 единиц — 0,23 м3;
- Двойная для 204 блоков — 0,24 м3.

Затраты кирпича на 1м
3 стеныВычисления затрат опираются на нормативы затрат блоков плюс расход раствора на 1 м3 для изделий разных размеров.
Чтобы рассчитать объем основания, следует умножить между собой ширину, длину и высоту сооружения, минус окна, двери и другие пустоты: V = a ∙ b∙ c, где a – длина, b – ширина, с — высота. Проще всего использовать Калькулятор расхода кирпича.
Сколько понадобится строительных изделий и какой будет расход раствора на 1 м3 сплошной перегородки – примерные данные приведены в таблице ниже:
| Разновидность изделий | Материал (измеряется в м3 и шт.) | Толщина стен в см | ||||
| 12 | 25 | 38 | 51 | 64 | ||
| Рядовой | Блоки | 420 | 400 | 396 | 395 | 393 |
| Рабочая смесь | 0,19 | 0,22 | 0,235 | 0,246 | ||
| Модулированный | Блоки | 32 | 309 | 295 | 295 | 293 |
| Рабочая смесь | 0,17 | 0,21 | 0,215 | 0,22 | 0,228 | |
При размерах строительных блоков:
- Одинарный: 250 мм х 120 мм х 65 мм;
- Полуторный: 250 мм х 120 мм * 88 мм;
- Двойной: 250 мм х 120 мм х 138 мм.

Как рассчитать количество единиц для цоколя?
Предварительно рассчитав объем всей стены, будет проще вычислить количество блочных изделий на цоколь, а также расход бетона для заливки.
Принцип действия: определяется объем цоколя, и результат делится на объем одного рядового изделия. Результатом будет количество блоков, необходимое для возведения цокольной стены.
Таким же образом можно рассчитать и облицовочную основу. Чтобі не ошибиться, лучше использовать Калькулятор расхода кирпича.
| Разновидность | Толщина | |||||
| Полкирпича (12 см) | Один (25 см) | Полтора (38 см) | Два (51 см) | Два с половиной (64 см) | ||
| Рядовой размером 250 x 120 x 65 мм | Строительный блок (шт.) | 420 | 400 | 395 | 395 | 393 |
| Смесь (м3) | 0,19 | 0,22 | 0,235 | 0,240 | 0,245 | |
| Модулированный размером 250 х 120 х 88 мм | Строительный блок (шт. ) ) | 320 | 309 | 295 | 294 | 293 |
| Смесь (м3) | 0,17 | 0,21 | 0,215 | 0,22 | 0,228 | |
Расход цемента в мешках для 1 м
2 стеныЕсли не использовать калькулятор расхода раствора на квадратный метр стены или цоколя, то довольно точный расчет включает в себя три операции:
- Вычислить общий объем стены;
- Рассчитать общий объем рабочего состава на кирпичную кладку;
- Определить, сколько потребуется цемента.
Пример:
Нужно узнать объем цемента для наружной стены размером 1000 х 1200 х 51 см, высотой 320 см из рядового изделия размером 250 х 120 х 65 мм.
Алгоритм вычислений следующий: рассчитываем общий объем стены. Для этого длину стены умножаем на толщину и высоту: (1000 + 1000 + 1200 + 1200) х 320 х 51 = 71,8 м3. Дальше вычисляем объем смеси, он будет равен 0,24 м3. Общий объем будет равен: 71,8 х 0,24 = 17,23 м3. При пропорциях в смеси 1:4 объем цемента: 17,23 делим на 4, получаем 4,3 м3.
При пропорциях в смеси 1:4 объем цемента: 17,23 делим на 4, получаем 4,3 м3.
Портландцемент фасуется в мешках 25 или 50 кг, поэтому, учитывая среднюю плотность материала (1300 кг/м3), получаем: 4,3 х 1300 = 5600 кг. 5600 делим на 50 кг, понадобится около 112 мешков цемента на кирпичную кладку.
Заключение
Расчет строительных изделий и сыпучих материалов для приготовления рабочей смеси, обычно проводится для цемента распространенных марок М25-М400, которые применяют при строительстве сооружений. Параллельно, при вычислениях принимается во внимание вид строительных изделий, разновидности кладки и толщина шва. Количество изделий, рассчитывается поштучно, для каждого ряда, или для всей поверхности.
Читайте далее:
3.4: Концентрации растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 221455
- Эллисон Сульт
- Университет Кентукки
Результаты обучения
- Определение концентрации.

- Используйте термины «концентрированный» и «разбавленный» для описания относительной концентрации раствора.
- Рассчитайте молярность раствора.
- Расчет процентной концентрации (м/м, об/об, м/об).
- Опишите раствор с концентрацией в \(\text{ppm}\) или \(\text{ppb}\).
- Используйте единицы измерения концентрации в расчетах.
- Определите эквиваленты для иона.
- Завершите расчеты относительно эквивалентов молей, объемов или массы.
- Завершить расчет разбавления.
Существует несколько способов выражения количества растворенного вещества в растворе. Концентрация раствора является мерой количества растворенного вещества, растворенного в данном количестве растворителя или раствора . Концентрированный раствор содержит относительно большое количество растворенного вещества. Разбавленный раствор содержит относительно небольшое количество растворенного вещества . Однако эти термины относительны, и нам нужно уметь выражать концентрацию более точным, количественным образом. Тем не менее, концентрированный и разбавленный полезны как термины для сравнения одного раствора с другим (см. рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что отношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Однако эти термины относительны, и нам нужно уметь выражать концентрацию более точным, количественным образом. Тем не менее, концентрированный и разбавленный полезны как термины для сравнения одного раствора с другим (см. рисунок ниже). Также имейте в виду, что термины «концентрировать» и «разбавлять» могут использоваться как глаголы. Если бы вы нагревали раствор, вызывая испарение растворителя, вы бы концентрировали его, потому что отношение растворенного вещества к растворителю увеличивалось бы. Если бы вы добавили больше воды в водный раствор, вы бы разбавили его, потому что отношение растворенного вещества к растворителю уменьшилось бы.
Концентрация в процентах
Одним из способов описания концентрации раствора является процентная доля раствора, состоящего из растворенного вещества. Этот процент может быть определен одним из трех способов: (1) масса растворенного вещества, деленная на массу раствора, (2) объем растворенного вещества, деленная на объем раствора, или (3) масса растворенного вещества. растворенного вещества разделить на объем раствора. Поскольку эти методы обычно дают немного разные значения, важно всегда указывать, как был рассчитан данный процент.
растворенного вещества разделить на объем раствора. Поскольку эти методы обычно дают немного разные значения, важно всегда указывать, как был рассчитан данный процент.
Массовый процент
Когда растворенное вещество в растворе является твердым, удобным способом выражения концентрации является массовый процент (масса/масса), который представляет собой граммы растворенного вещества на \(100 \: \text{g} \) решения.
\[\text{Проценты по массе} = \frac{\text{масса растворенного вещества}}{\text{масса раствора}} \times 100\%\]
Предположим, что раствор был приготовлен путем растворения \ (25,0 \: \text{г}\) сахара в \(125 \: \text{г}\) воды. Процент по массе будет рассчитываться следующим образом: 93 \: \text{g} \right)\), чтобы вычислить массу воды, которую необходимо добавить.
Объемный процент
Процентное содержание растворенного вещества в растворе легче определить по объему, когда растворенное вещество и растворитель являются жидкостями. Объем растворенного вещества, разделенный на объем раствора, выраженный в процентах, дает процент по объему (объем/объем) раствора. Если раствор готовят, беря \(40. \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240. \: \text{мл}\) раствора, процент по объему равен:
Объем растворенного вещества, разделенный на объем раствора, выраженный в процентах, дает процент по объему (объем/объем) раствора. Если раствор готовят, беря \(40. \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240. \: \text{мл}\) раствора, процент по объему равен:
\[\begin{align} \text{Проценты по объему} &= \frac{\text{объем растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{ 40 \: \text{мл этанола}}{240 \: \text{мл раствора}} \times 100\% \\ &= 16,7\% \: \text{этанол} \end{align}\]
Часто , на этикетках ингредиентов пищевых продуктов и лекарств количества указаны в процентах (см. рисунок ниже).
Рисунок 8.1.2: Перекись водорода обычно продается в виде \(3\%\) по объему раствора для использования в качестве дезинфицирующего средства. Следует отметить, что, в отличие от массы, нельзя просто сложить объемы растворенного вещества и растворителя, чтобы получить окончательный объем раствора. При совместном добавлении растворенного вещества и растворителя масса сохраняется, но не всегда сохраняется объем. В некоторых случаях, как в приведенном выше примере, раствор готовили, начиная с \(40 \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240 \: \text{мл}\) этанола. решение. Простое смешивание \(40 \: \text{мл}\) этанола и \(200 \: \text{мл}\) воды не даст вам такого же результата, так как окончательный объем, вероятно, не будет точно \( 240 \: \text{мл}\).
В некоторых случаях, как в приведенном выше примере, раствор готовили, начиная с \(40 \: \text{мл}\) этанола и добавляя достаточное количество воды, чтобы получить \(240 \: \text{мл}\) этанола. решение. Простое смешивание \(40 \: \text{мл}\) этанола и \(200 \: \text{мл}\) воды не даст вам такого же результата, так как окончательный объем, вероятно, не будет точно \( 240 \: \text{мл}\).
Массово-объемный процент
Массово-объемный процент также используется в некоторых случаях и рассчитывается аналогично предыдущим двум процентам. Процент массы/объема рассчитывается путем деления массы растворенного вещества на объем раствора и выражения результата в процентах.
Например, если раствор готовится из \(10 \: \ce{NaCl}\) в воде, достаточной для приготовления раствора \(150 \: \text{мл}\), массовая концентрация будет равна
\[\begin{align} \text{Объемно-массовая концентрация} & \frac{\text{масса растворенного вещества}}{\text{объем раствора}} \times 100\% \\ &= \frac{10 \: \text{g} \: \ce{NaCl}}{150 \: \text{мл раствора}} \times 100\% \\ &= 6,7\% \end{align}\]
Части на миллион и Части на миллиард
Двумя другими единицами концентрации являются части на миллион и части на миллиард. Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы намного проще, если рассматривать процент как часть на сотню. Помните, что \(85\%\) эквивалентно 85 из ста. Раствор, который является \(15 \: \text{ppm}\), составляет 15 частей растворенного вещества на 1 миллион частей раствора. Раствор \(22 \: \text{ppb}\) содержит 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Эти единицы используются для очень малых концентраций растворенных веществ, таких как количество свинца в питьевой воде. Понять эти две единицы намного проще, если рассматривать процент как часть на сотню. Помните, что \(85\%\) эквивалентно 85 из ста. Раствор, который является \(15 \: \text{ppm}\), составляет 15 частей растворенного вещества на 1 миллион частей раствора. Раствор \(22 \: \text{ppb}\) содержит 22 части растворенного вещества на миллиард частей раствора. Хотя существует несколько способов выражения двух единиц \(\text{ppm}\) и \(\text{ppb}\), мы будем рассматривать их как \(\text{mg}\) или \(\mu \ text{g}\) растворенных веществ на \(\text{L}\) раствор соответственно.
Например, \(32 \: \text{ppm}\) может быть записано как \(\frac{32 \: \text{мг растворенного вещества}}{1 \: \text{L раствор}}\), а \(59 \: \text{ppb}\) можно записать как \(\frac{59 \: \mu \text{g раствор}}{1 \: \text{L раствор}}\).
Молярность
Химикам в первую очередь нужно, чтобы концентрация растворов выражалась таким образом, чтобы учитывалось количество присутствующих частиц, которые могут реагировать в соответствии с конкретным химическим уравнением. Поскольку процентные измерения основаны либо на массе, либо на объеме, они, как правило, бесполезны для химических реакций. Предпочтительной является единица концентрации, основанная на молях. молярность \(\left( \text{M} \right)\) раствора — это количество молей растворенного вещества, растворенного в одном литре раствора . Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
Поскольку процентные измерения основаны либо на массе, либо на объеме, они, как правило, бесполезны для химических реакций. Предпочтительной является единица концентрации, основанная на молях. молярность \(\left( \text{M} \right)\) раствора — это количество молей растворенного вещества, растворенного в одном литре раствора . Чтобы рассчитать молярность раствора, нужно количество молей растворенного вещества разделить на объем раствора, выраженный в литрах.
\[\text{Молярность} \: \left( \text{M} \right) = \frac{\text{моли растворенного вещества}}{\text{литры раствора}} = \frac{\text{ mol}}{\text{L}}\]
Обратите внимание, что объем указан в литрах раствора, а не в литрах растворителя. Когда сообщается молярность, единицей измерения является символ \(\text{M}\), который читается как «молярность». Например, раствор, обозначенный как \(1,5 \: \text{M} \: \ce{NH_3}\), представляет собой «1,5 молярный раствор аммиака».
Пример 8.1.1
Раствор готовят путем растворения \(42,23 \: \text{g}\) \(\ce{NH_4Cl}\) в воде, достаточной для получения \(500,0 \: \text{мл }\) решения. Вычислите его молярность.
Вычислите его молярность.
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Масса \(\ce{NH_4Cl} = 42,23 \: \text{g}\)
- Молярная масса \(\ce{NH_4Cl} = 53,50 \: \text{г/моль}\)
- Объем раствора \(= 500,0 \: \text{мл} = 0,5000 \: \text{л}\)
Неизвестно
- Молярность \(= ? \: \text{M}\)
Массу хлорида аммония сначала переводят в моли. Затем вычисляют молярность путем деления на литры. Обратите внимание, что данный объем был преобразован в литры.
Шаг 2: Решить.
\[42,23 \: \text{g} \: \ce{NH_4Cl} \times \frac{1 \: \text{моль} \: \ce{NH_4Cl}}{53,50 \: \text{g} \: \ce{NH_4Cl}} = 0,7893 \: \text{моль} \: \ce{NH_4Cl}\]
\[\frac{0,7893 \: \text{моль} \: \ce{NH_4Cl}}{0,5000 \: \text{L}} = 1,579 \: \text{M}\]
Шаг 3: Подумайте о своем результате .
Молярность \(1,579 \: \text{M}\), что означает, что литр раствора будет содержать 1,579 моль \(\ce{NH_4Cl}\). Уместно наличие четырех значащих цифр.
Уместно наличие четырех значащих цифр.
Разведения
При добавлении дополнительного количества воды к водному раствору концентрация этого раствора уменьшается. Это связано с тем, что количество молей растворенного вещества не меняется, а общий объем раствора увеличивается. Мы можем установить равенство между молями растворенного вещества до разбавления (1) и молями растворенного вещества после разбавления (2).
\[\text{моль}_1 = \text{моль}_2\]
Поскольку моль растворенного вещества в растворе равна молярности, умноженной на объем в литрах, мы можем установить их равными.
\[M_1 \times L_1 = M_2 \times L_2\]
Наконец, поскольку две части уравнения установлены равными друг другу, объем может быть в любых выбранных нами единицах, если эта единица является одинаково с обеих сторон. Наше уравнение для расчета молярности разбавленного раствора принимает следующий вид:
\[M_1 \times V_1 = M_2 \times V_2\]
Кроме того, концентрация может быть выражена в любых других единицах, если \(M_1\) и \( M_2\) находятся в одном блоке.
Предположим, что у вас есть \(100. \: \text{mL}\) раствора \(2.0 \: \text{M}\) \(\ce{HCl}\). Вы разбавляете раствор, добавляя достаточное количество воды, чтобы сделать объем раствора \(500. \: \text{мл}\). Новую молярность можно легко рассчитать, используя приведенное выше уравнение и решив \(M_2\).
\[M_2 = \frac{M_1 \times V_1}{V_2} = \frac{2.0 \: \text{M} \times 100. \: \text{mL}}{500. \: \text{мл}} = 0,40 \: \text{M} \: \ce{HCl}\]
Раствор разбавлен в пять раз, так как новый объем в пять раз больше исходного оригинальный объем. Следовательно, молярность составляет одну пятую от первоначального значения. Другая распространенная проблема разбавления заключается в том, чтобы решить, сколько высококонцентрированного раствора требуется для получения желаемого количества раствора с более низкой концентрацией. Высококонцентрированный раствор обычно называют исходным раствором.
Пример 8.1.2
Азотная кислота \(\left( \ce{HNO_3} \right)\) является мощной и агрессивной кислотой. При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
При заказе в компании-поставщике химикатов его молярность составляет \(16 \: \text{M}\). Сколько исходного раствора азотной кислоты нужно использовать, чтобы получить \(8,00 \: \text{L}\) из \(0,50 \: \text{M}\) раствора?
Решение:
Шаг 1: Перечислите известные количества и спланируйте задачу.
Известный
- Запас \(\ce{HNO_3} \: \left( M_1 \right) = 16 \: \text{M}\)
- \(V_2 = 8.00 \: \text{L}\)
- \(М_2 = 0,50 \: \текст{М}\)
Неизвестно
- Объем запаса \(\ce{HNO_3} \: \left( V_1 \right) = ? \: \text{L}\)
Неизвестным в уравнении является \(V_1\), необходимый объем концентрированного маточного раствора.
Шаг 2: Решить.
\[V_1 = \frac{M_2 \times V_2}{V_1} = \frac{0,50 \: \text{M} \times 8,00 \: \text{L}}{16 \: \text{M} } = 0,25 \: \text{L} = 250 \: \text{мл}\]
Шаг 3: Подумайте о своем результате.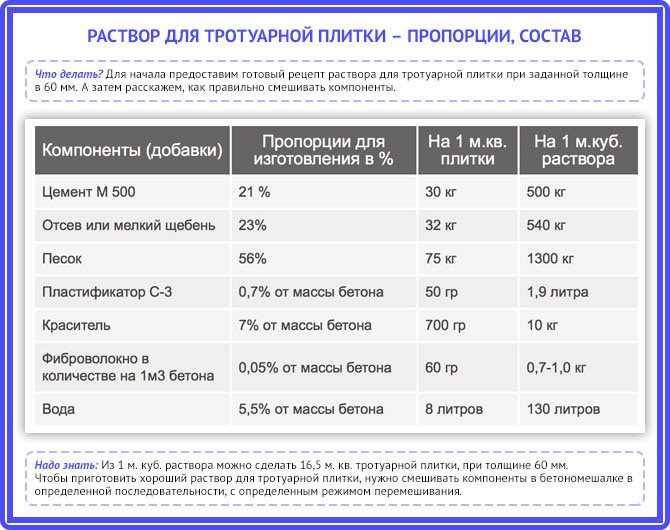
\(250 \: \text{мл}\) исходного \(\ce{HNO_3}\) раствора необходимо разбавить водой до конечного объема \(8,00 \: \text{л}\ ). Разбавление от \(16 \: \text{M}\) до \(0,5 \: \text{M}\) равно 32.
Эквиваленты
много способов. Также очень важно использовать единицы с любыми значениями, чтобы обеспечить правильную дозировку лекарств или сообщать об уровнях веществ в крови, и это только два. 9{2-}} & 2 \end{array}\]
Эквиваленты используются, поскольку концентрация зарядов важнее, чем идентичность растворенных веществ. Например, стандартный раствор для внутривенного введения не содержит тех же растворенных веществ, что и кровь, но концентрация зарядов такая же.
Иногда концентрация ниже, и в этом случае миллиэквиваленты \(\left( \text{mEq} \right)\) являются более подходящей единицей измерения. Так же, как метрические префиксы, используемые с базовыми единицами, милли используются для изменения эквивалентов, поэтому \(1 \: \text{Eq} = 1000 \: \text{mEq}\). 9+}\]
9+}\]
Авторы
Эта страница под названием 3.4: Concentrations of Solutions распространяется по незаявленной лицензии и была создана, изменена и/или курирована Эллисон Сульт.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Эллисон Сульт
- Показать страницу TOC
- № на стр.
- Теги
- концентрация
- частей на миллион
- источник[1]-chem-155677
- источник[2]-chem-58828
- источник[3]-хим-155677
- источник-хим-58828
4.
 5: Концентрация растворов — Химия LibreTexts
5: Концентрация растворов — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21718
Цели обучения
- Количественное описание концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора равна количеству растворенное вещество , которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{ 4.5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер \]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right ) = ммоль \label{4.5.3} \]
Рисунок \(\PageIndex{1}\) иллюстрирует использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3} \).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей натрия гидроксида (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4. 5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланина.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube (opens in new window) [youtu.be]
Концентрации также часто указываются в пересчете на массу (m/m) или на основе отношения массы к объему (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммов растворенного вещества на 10 9 г раствора решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллиард ), что составляет граммов растворенного вещества на 10 9 г раствора решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего указанную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на меньше, чем на желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 • 2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0 .500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения жидкостей организма, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив число молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\( V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде.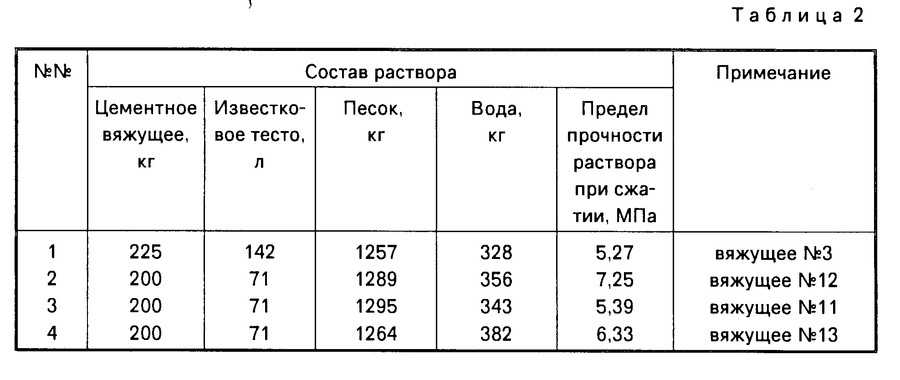 Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующих молей растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0032
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующих молей растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0032
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до метки объема ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М исходного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \номер\]
При определении необходимого объема маточного раствора мы должны были разделить желаемое число молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г дихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (водн.)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (водн.)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 дает раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды опущены из молекулярного представления раствора для ясности.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 — , также должен быть 1,43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43. 2 − ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 produces three ions when dissolved in water (2NH 4 + + 1Cr 2 O 7 2 − ), the total concentration of ions в растворе 3 × 1,43 М = 4,29 М.
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (CH 3 ) 2 CHOH
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH дает один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
B Одна единица формулы IN (NO 3 ) 3 производит один в 3 + Ion и три NO 3 — 4 Ion, SO A.0.032 M 2 — 4, SO A.0.032 M. 405141414141414141414141414 гг. 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 — — это, [в 3 9 44444444444444444444,444444444444444444 44444444444444 444444 4444444444 444444444 44444 4444444 44444 4444444 44444. − ] = 0,096 М.
− ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, обычно известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моль\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитров\: из \: решение} \номер \]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражают в виде молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).0055 ) до желаемого конечного объема.
Концентрации обычно выражают в виде молярности , определяемой как число молей растворенного вещества в 1 л раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор 9).0055 ) до желаемого конечного объема.
Авторы и авторство
4.5: Concentration of Solutions распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.




 Стандартное соотношение компонентов – три к одному или четыре к одному;
Стандартное соотношение компонентов – три к одному или четыре к одному;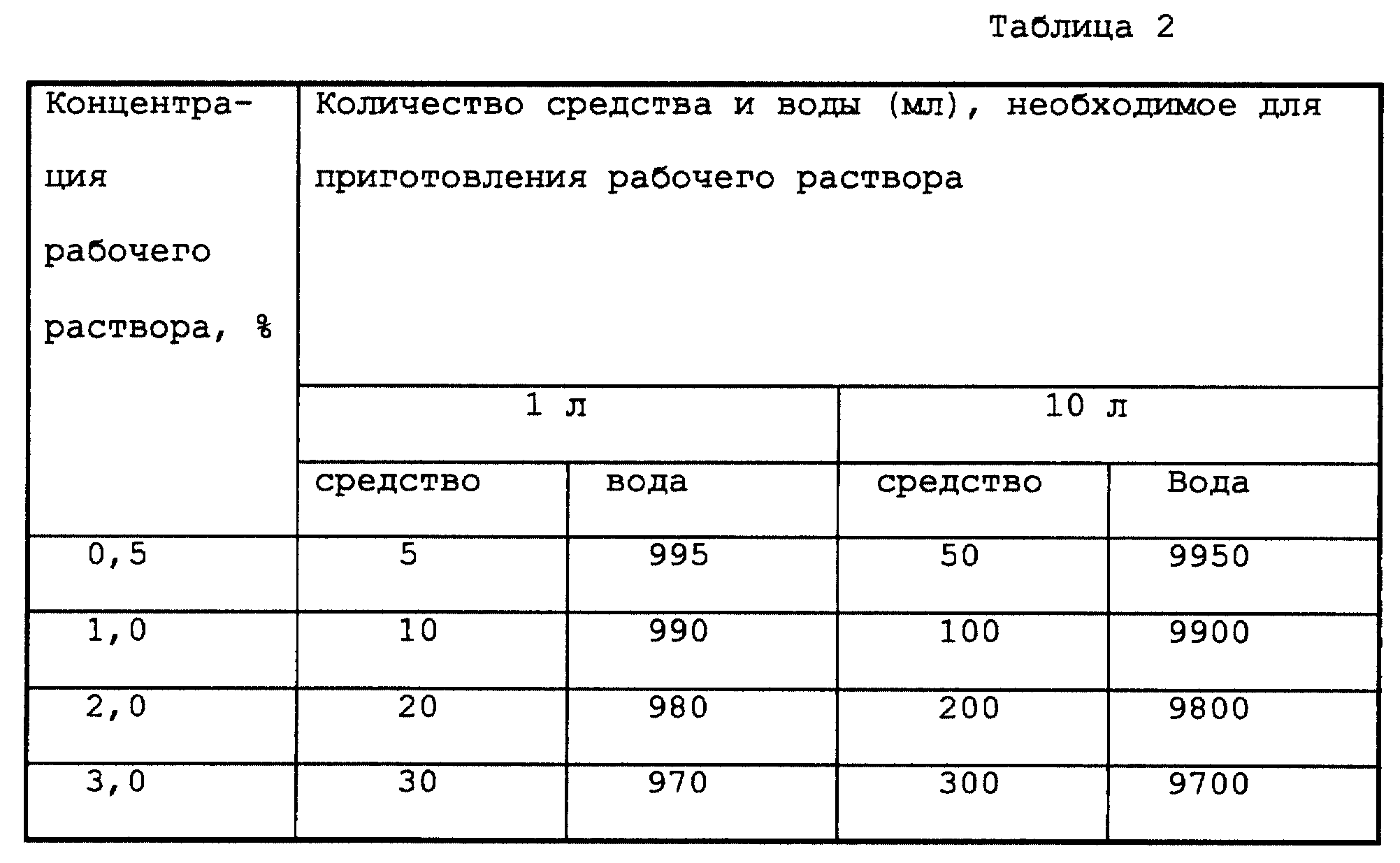 На один квадратный метр основания потребляется приблизительно 100-105 брикетов.
На один квадратный метр основания потребляется приблизительно 100-105 брикетов.


